Vier Milliarden Jahre alte Proteine in Labor rekonstruiert
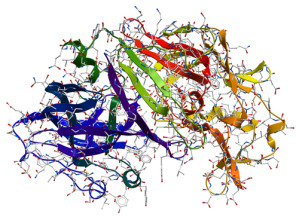
„Bisher basierten Versuche, um die Evolution von Protein-Strukturen zu verstehen, lediglich auf Vergleichen moderner Eiweiße“, sagt Jose Sanchez-Ruiz von der University of Granada. Dies wäre aber genau so, als ob wir uns bemühen würden, die Evolution der Vögel lediglich durch Vergleiche heute lebender Arten zu begreifen. Daher hatten die spanischen Biochemiker eine Methode angewandt, die sich „ancestral sequence reconstruction“ nennt. Dabei rekonstruierten die Forscher erst einmal den Stammbaum von Thioredoxinen, indem sie den Aufbau dieser Moleküle in ganz unterschiedlichen Lebewesen miteinander verglichen – vom Ur-Bakterien bis hin zu den Säugetieren. Daraus errechneten sie mittels statistischer Methoden, wie die Abfolge der Bausteine in den archaischen Proteinen ausgesehen haben müsste. In einem weiteren Schritt bestimmten die Forscher dann den Aufbau von Genen, die den Befehl für die Produktion der Ur-Proteine enthielten. Diese Gene schleusten sie in Bakterien ein. Daraufhin produzierten die Bakterien die Ur-Proteine in ausreichenden Mengen für die nachfolgende Kristallstrukturanalyse.
Die Forscher gehen davon aus, dass ihre Labor-Produkte ziemlich genau den Strukturen vergleichbarer Proteine vor vier Milliarden Jahren entsprechen – quasi „Protein-Fossilien“ aus dem Präkambrium (der Erdfrühzeit vor 4,6 Milliarden bis 540 Millionen Jahren). Selbst bei unterschiedlicher Abfolge der Bausteine hatten die rekonstruierten Produkte einen sehr ähnlichen Aufbau ihrer dreidimensionalen Struktur wie moderne Thioredoxine. Solche Übereinstimmungen deuten gemeinhin auf wichtige biologische Funktionen hin, die erhalten werden müssen. Auch heute haben Thioredoxine wesentliche Aufgaben. So sind die Proteine beim Menschen als Antioxidans und als Regulator biochemischer Signalübertragungen wirksam.


 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 