Herpesvirus im Röntgenlicht
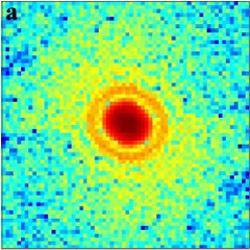
"Mit diesem wichtigen Bildgebungsverfahren lassen sich die Strukturen von zahlreichen biologischen Systeme vom einzelnen Protein über Viren bis zu ganzen Zellen entschlüsseln", schreiben Jianwei Miao und seine Kollegen von der University of California in Los Angeles. Für ihre Röntgenaufnahmen nutzten sie das gut kontrollierbare Licht der japanischen Synchrotronquelle Spring8. Einzelne Herpesviren verteilten sie in Methanol und deponierten sie auf eine nur 30 Nanometer dünne Membran aus Siliziumnitrid.
Trifft nun das monochromatische Röntgenlicht von fünf Kiloelektronenvolt auf dieses Virus-Präparat, wird es abhängig von der Virusstruktur gestreut. Mit dem tiefgekühlten Bildchip einer CCD-Kamera fingen sie die gestreuten Röntgenstrahlen auf und erhielten ein komplexes Beugungsmuster. Mit einem Rechner lässt sich dieses so genau auswerten, dass Strukturen fast bis auf zum atomaren Aufbau des Virus sichtbar werden.
Für diese im Prinzip schon seit Jahrzehnten angewandte Methode der Röntgendiffraktion brauchten Biologen und Physiker bisher hochreine Einkristalle aus Proteinen oder Enzymen, um deren Struktur entschlüsseln zu können. Die Intensität der gestreuten Röntgenstrahlen wäre sonst für eine Strukturanalyse viel zu schwach. Mit dem geschickten Versuchsaufbau gelingt es nun aber auch, ohne solche Kristalle die Struktur von einzelnen Viren zu entschlüsseln. Das eröffnet ein weites Feld für die Untersuchung von biologischen Proben, die sich nicht in Kristalle bannen ließen.
Miao ist fest überzeugt, dass sich diese Röntgenanalysen mit zukünftigen Synchrotronquellen und Freien Elektronen-Lasern (FEL) weiter verbessern lassen. Auch am FEL-Projekt, das derzeit am Deutschen Elektronensynchrotron in Hamburg betrieben wird, wird an diesen Anwendungen gearbeitet. Nach Erfolgen mit einem kleineren FEL entsteht hier ab 2009 der Europäische Röntgenlaser - XFEL, der nicht nur die Proben von Biologen, sondern auch die von Chemikern, Physikern und Materialforschern in einem völlig neuen, detailreichen Licht erscheinen lassen soll.
http://arxiv.org/abs/0806.2875


 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 