Wasser als Katalysator
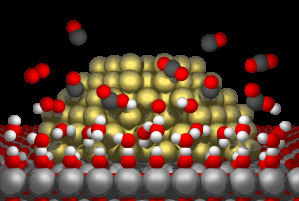
„Der ko-katalytische Effekt von Wasser könnte einen Weg zu effizienteren Reaktionen weit über die CO-Oxidation hinaus eröffnen“, sagt Lars Grabow, ein aus Deutschland stammender Ingenieur der Verfahrenstechnik. Mit seinen Kollegen der University of Houston und der Trinity University in San Antonio ging er den einzelnen Reaktionschritten sowohl im Experiment als auch in einer vereinfachten Modellrechnung nach, um den reaktionsfördernden Einfluss von Wassermolekülen zu verstehen. „Unsere Ergebnisse zeigen, dass schon kleine Wassermengen ausreichen, um aktiv an der CO-Oxidation an Gold-Titandioxid-Partikeln teilzunehmen und die Reaktion signifikant zu beschleunigen“, fasst Grabow die Ergebnisse zusammen.
Damit Kohlenmonoxid ein weiteres Sauerstoffatom aufnehmen konnte, waren mehrere Teilschritte nötig: Sauerstoffmoleküle wurden dank der winzigen Goldpartikel gespalten, die auf einer Unterlage aus Titandioxid gelagert wurden. So aktiviert bildeten sich in Gegenwart weniger Wassermoleküle sogenannte Hydroxyl-Gruppen (OH-), die an Kohlendioxid-Moleküle andocken konnten. Darauf löste sich ein Wasserstoffatom, das mit einer weiteren Hydroxyl-Gruppe wieder Wasser bildete. Das gewünschte Kohlendioxid-Molekül blieb zurück. Vergleichsversuche im trockenen Hochvakuum und ohne Gegenwart von Wassermolekülen verliefen signifikant langsamer und weniger effizient.
Dieses Ergebnis zeigt, dass bei der CO-Oxidation Wassermoleküle die Rolle eines Ko-Katalysators übernehmen. Mit diesem Wissen könnten katalytische Reaktionen an Gold-Titandioxid-Partikeln weiter optimiert werden. Angewandt auf die CO-Oxidation ließe sich so reinerer Wasserstoff aus Erdgas gewinnen, da bei diesem Prozess immer auch störendes CO erzeugt wird. CO ist unerwünscht, da das giftige Gas schon in kleinen Mengen die effiziente Umsetzung von Wasserstoff etwa in Brennstoffzellen stören kann.

 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 