Verbesserte Chemo: Wie resistente Krebszellen wieder therapierbar werden
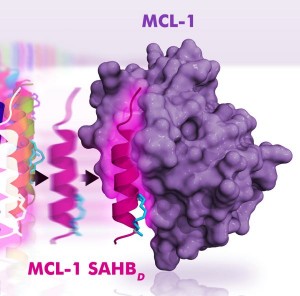
"Das ist ein sehr wichtiger Schritt zur Entwicklung eines Hemmstoffs für das Protein MCL-1, das sich immer mehr als kritischer Überlebensfaktor von Zellen eines großen Spektrums menschlicher Krebsformen erweist", sagt Loren Walensky vom Dana-Farber Cancer Institute in Boston. MCL-1 gehört zu einer Gruppe von Proteinen, die verhindern, dass die Apoptose, der programmierte Zelltod, ausgelöst wird. Durch diesen Selbstzerstörungsmechanismus eliminiert der Körper normalerweise geschädigte oder entartete Zellen. Bei therapieresistenten Krebsformen von Melanomen, multiplen Myelomen und speziellen Formen von Leukämie und Brustkrebs produzieren die Krebszellen MCL-1 im Überschuss. Dieses Protein blockiert den Signalweg, der zum Absterben der Zelle führt, indem es sich an Apoptose-fördernde Proteine anlagert.
Zunächst hatten die Forscher die chemische Struktur der Andockstelle genau analysiert und dann nach Eiweißmolekülen gesucht, die passgenau an dieser Stelle des MCL-1-Moleküls binden. Sie fanden ein kleines Peptid in Alpha-Helixstruktur, das die Bindungsstelle effektiv blockierte und so die Funktion des Proteins hemmte. In Versuchen mit Leukämiezellen ließ sich durch das Peptid der Apoptose-Signalweg leichter aktivieren, was die Wirksamkeit von Krebsmitteln verstärken würde. Eine solche Zusatzbehandlung könnte eine nebenwirkungsarme Therapie mit Medikamenten ermöglichen, gegen die die Krebszellen bereits resistent geworden sind. Zunächst aber soll der Einsatz des Peptids in der Chemotherapie durch Tierversuche geprüft werden.


 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 