Tuberkulosebakterien in den Selbstmord treiben
„Wenn wir Moleküle finden, die die Bindung zwischen Toxin und Antitoxin verhindern und damit den Zelltod auslösen, wäre das das perfekte Medikament“, sagt Annabel Parret aus der Forschungsgruppe Matthias Wilmanns am European Molecular Biology Laboratory (EMBL) in Hamburg. Zusammen mit Kollegen aus Frankreich und Großbritannien untersuchte sie die zahlreichen Toxin-Antitoxin-Kombinationen von M. tuberculosis. Als besonders interessant erwies sich das Toxin MbcT. Dieses Protein ist bei normalem Wachstum stets fest verbunden mit einem zweiten Protein (MbcA), das als Antitoxin wirkt. Unter Stressbedingungen wird das Antitoxin abgebaut und das dadurch aktivierte Toxin tötet das Bakterium.
Wie die Forscher nachweisen konnten, ist MbcT ein Enzym, das die Verbindung NAD (Nicotinamid-Adenindinukleotid) abbaut. NAD ist ein für jede Zelle lebensnotwendiges Coenzym, das an zahlreichen Stoffwechselprozessen beteiligt ist. Die biologische Funktion dieses und anderer Toxin-Antitoxin-Systeme ist noch nicht geklärt. Möglicherweise drosselt das aktivierte Toxin bei Nährstoffmangel die Vermehrung einer Bakterienpopulation und sichert durch „Selbstaufopferung“ einzelner Bakterien das Überleben der Kolonie. Ist ein Bakterium von einer Virusinfektion befallen, läge der Nutzen eines Selbstmords darin, die weitere Ausbreitung der Viren innerhalb der Population zu verhindern.
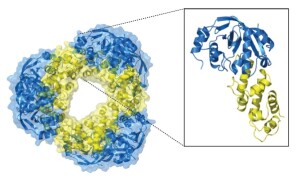
Die Forscher konnten die dreidimensionale Molekülstruktur des Toxin-Antitoxin-Komplexes aufklären, dessen Gesamtform sich als doppelter Donut beschreiben lässt. „Er sieht aus wie ein Diamant und ist sehr stabil“, sagt Wilmanns. Die Wissenschaftler erzeugten einen genetisch veränderten Stamm des Tuberkulosebakteriums, dem das Antitoxin-Gen fehlte und bei dem das Toxin künstlich aktiviert werden konnte. Wenn sie Zellen von Menschen oder Mäusen mit solchen Bakterien infizierten und dann die Toxinbildung auslösten, sank die Zahl der Erreger in den Zellen. Bei Experimenten mit infizierten Mäusen verlängerte sich dadurch die Überlebenszeit der Tiere um 40 Prozent im Vergleich zur Infektion mit normalen Bakterien.
Das spricht dafür, dass es prinzipiell möglich wäre, durch Blockierung des Antitoxins – zusätzlich zur Verabreichung von Antibiotika – die Tuberkulosetherapie zu verbessern. Da die Häufigkeit resistenter Erreger zunimmt, werden dringend neue Behandlungsmethoden benötigt, um eine der weltweit bedeutendsten tödlichen Infektionskrankheiten effektiver bekämpfen zu können. Die Forscher suchen nun nach Wirkstoffen, die die Bindung zwischen Toxin und Antitoxin lösen beziehungsweise verhindern oder das Antitoxin direkt inaktivieren. Diese könnten dann zusammen mit den Standardmedikamenten bei der Tuberkulosetherapie eingesetzt werden. Eine entsprechende Strategie für andere Toxin-Antitoxin-Kombinationen wäre nach Ansicht der Autoren auch für weitere Infektionskrankheiten denkbar.


 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 