Scharfer Blick auf Biomoleküle
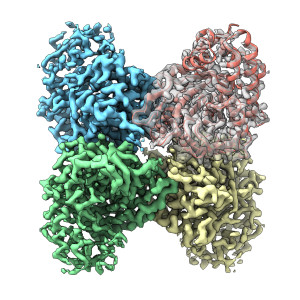
„Ich habe nie erwartet, dass wir mit dieser Technik die Ordnung von Wassermolekülen oder Seitenketten komplexer Moleküle beobachten könnten“, sagt Gabriel C. Lander vom Scripps Research Institute im kalifornischen La Jolla. Dieser exakte Blick auf Biomoleküle gelang ihm und seinen Kollegen nun sogar mit einem Elektronenmikroskop, das eigentlich nur für eine gröbere Ansicht vorgesehen war. An einzelnen Proben erreichten sie eine Auflösung von weniger als drei Zehntel Nanometer. Eine so genaue Strukturanalyse war bislang nur mit deutlich teureren Elektronenmikroskopen möglich.
Bei der Kryo-Elektronenmikroskopie (Kryo-EM) treffen wie bei einem herkömmlichen Transmissionselektronenmikroskop – kurz TEM genannt – beschleunigte Elektronen auf eine sehr dünne Probe. Die Elektronen werden an den Atomen eines Moleküls gestreut. So entsteht ein Beugungsbild, das hinter der Probe mit empfindlichen Elektronendetektoren aufgenommen und im Rechner analysiert werden kann. Die Nobelpreisträger waren die ersten, die vorschlugen, Biomoleküle möglichst schnell auf unter minus 150 Grad Celsius abzukühlen. Auf diese schockgefrorenen Proben werden die beschleunigten Elektronen gelenkt. Aus mehreren Beugungsaufnahmen lassen sich dreidimensionale Strukturbilder selbst komplexer Biomoleküle berechnen. Je schneller die Elektronen sind, desto dickere Proben können genauer untersucht werden.
Lander und Kollegen nutzten nun relativ langsame, nur mit Spannungen von 200 Kilovolt beschleunigte Elektronen. Die deutlich teureren Mikroskope nutzen höhere Spannungen von bis zu 300 Kilovolt. Zuerst setzten die Forscher schockgefrorene Proben wahlweise aus Enzymen und Proteinen auf ein filigranes Netz aus Goldfäden. Die an den Proben gestreuten Elektronen detektierten sie mit einem empfindlichen Elektronendetektor. Aus den so gewonnenen Beugungsbildern errechneten sie dreidimensionale Strukturen der Biomoleküle. Mit einer für sie selbst überraschend guten Auflösung von weniger als drei Zehntel Nanometern konnten sie sogar die Anordnung einzelner Wassermoleküle und die Ausrichtung von Seitenketten der komplexen Biomoleküle sichtbar machen.
Lander und seine Kollegen haben mit ihren hochaufgelösten Aufnahmen gezeigt, dass auch günstige Kryo-Elektronenmikroskope mit mittleren Beschleunigungsspannungen ausreichend gute 3D-Bilder von Biomolekülen aufnehmen können. Damit könnten deutlich mehr Forschergruppen als bisher von dieser Methode profitieren. Lander hält weitere Verbesserungen der Auflösung für möglich und ist den jüngsten Chemie-Nobelpreisträgern sehr dankbar. „Die drei Preisträger sind wahre Visionäre. Sie haben Generationen von Strukturbiologen inspiriert“, sagt Lander.
Noch genauere Bilder von Biomolekülen können zwar mit gestreuten Röntgenstrahlen, erzeugt mit teils mehrere hundert Meter langen Synchrotronringen, erzielt werden. Doch müssen die empfindlichen Proben dazu erst aufwendig kristallisiert werden. Das Schockgefrieren für die deutlich günstigere Untersuchung mit Kryo-Elektronenmikroskopen ist dagegen viel einfacher. Und mit Auflösungen von wenigen Zehntel Nanometern sind auch diese Bilder genau genug, um die Funktion der Biomoleküle im Detail verstehen zu können.


 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 