Momentaufnahme: Wie Proteinfabriken in unserem Körper arbeiten
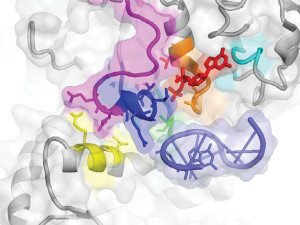
„Dies ist ein Thema, das unser gesamtes Forschungsfeld in der letzten Dekade verfolgt hat“, sagt Harry Noller von der University of California in Santa Cruz. Der Molekularbiologe arbeitet schon lange an der komplizierten atomaren Struktur von Ribosomen, die aus langen, ineinander verwundenen Ketten von Proteinen und RNA aufgebaut sind. RNA gehört wie die DNA, der Speicher unserer Erbinformationen, zu den Nukleinsäuren. Bei der Übersetzung von Erbinformationen in Proteine nimmt die RNA eine ganz entscheidende Rolle ein. Denn sie kommt nicht nur als Baustein in Ribosomen vor, sondern übernimmt in anderer Form ebenfalls wichtige Transport- und Koordinierungs-Funktionen in der Proteinsynthese. So stellen verschiedene RNA-Moleküle sicher, dass die Arbeiten im Ribosom synchronisiert werden. Denn bei einer Geschwindigkeit von 20 neuen Bausteinen pro Sekunde am wachsenden Proteinstrang könnte die Maschinerie sonst ganz schnell aus dem Tritt geraten. Und genau diesen Vorgang haben Noller und seine Kollegen jetzt analysiert.
Die Wissenschaftler nutzten Röntgenstrukturanalysen, um die Ribosomen während ihrer Interaktion mit anderen Molekülen abzubilden. Dabei wurden die Moleküle quasi bei der Arbeit in verschiedenen Schritten „eingefroren“ und fotografiert. Zu diesen Schritten gehört, dass die Erbinformationen erst einmal von der DNA abgelesen und kopiert werden müssen. Dies wird von einem darauf spezialisierten RNA-Molekül übernommen, das die Erbinformationen aus dem Zellkern zu den Ribosomen im Zellplasma trägt. Dort werden sie als Befehle in die Proteinfabrik eingespeist. Gleichzeitig trägt eine andere Form von RNA die einzelnen Bausteine der Proteine heran, die dann im Ribosom zu langen Eiweißketten verknüpft werden. Dadurch haben die Proteine ganz genau den Aufbau, der in den Erbinformationen festgelegt ist.
Der von Noller analysierte Schritt geschieht immer, nachdem ein neuer Baustein an die wachsende Proteinkette angesetzt wurde: Die RNA, die den neuen Baustein gebracht hatte, wandert zur nächsten Stelle im Ribosom. Synchron dazu bewegt sich auch die zweite RNA, die für den Transport der Erbinformationen zuständig ist. Auf den Aufnahmen von Noller ist zu erkennen, dass dieser wichtige Vorgang durch die Rotation einer kleinen Untereinheit des Ribosoms gesteuert wird. Dabei verhindert ein Mechanismus wie bei einer Ratsche oder einem Zahnrad, dass die Stränge aus der Spur geraten beziehungsweise ihren synchronen Lauf verlieren. Viele Antibiotika setzen bei Bakterien genau an diesem Schritt an und verhindern oder verlangsamen die Synchronisierung. „Je genauer wir die Prozesse verstehen, um so spezifischer können wir gegen die Erreger vorgehen“, schließt Noller.


 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 