Flexible Abwehrstrategie: Fehlerhaft hergestellte Proteine schützen Zellen bei Stress
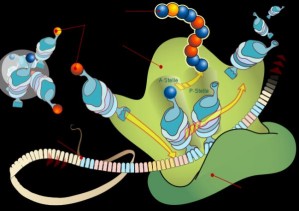
"Der genetische Code gilt als unantastbar, aber dies ist eine nicht genetische Strategie der Zellen zum Schutz der Proteine", sagt Tao Pan von der University of Chicago. Zusammen mit Jonathan Yewdell vom National Institute of Allergy and Infectious Diseases untersuchte er den Einbau von radioaktiv markiertem Methionin in neu gebildete Proteine von menschlichen Zellen aus Laborkulturen. Von den 20 Aminosäuren, die am Aufbau der Proteine beteiligt sind, ist Methionin neben Cystein die einzige, die Schwefel in Form einer SH-Gruppe enthält. Diese Gruppe neutralisiert reaktive Sauerstoffverbindungen, die bei Stress vermehrt entstehen.
Die Forscher stellten fest, dass die Zellen auf eine Infektion von Viren oder Bakterien oder die Zugabe reaktiver Sauerstoffverbindungen mit einer zehnfach erhöhten Methionin-Einbaurate reagierten. Auslöser dieser Reaktion waren die Sauerstoffverbindungen selbst. "Wir nehmen an, dass Methionin das aktive Zentrum eines Proteins vor der Oxidation schützen kann und so verhindert, dass die Funktion des Proteins völlig blockiert wird", sagt Jeffrey Goodenbour, ein Mitglied des Forschungsteams. Bisher glaubte man, dass - abgesehen von einer sehr geringen natürlichen Fehlerrate - die Aneinanderkettung der verschiedenen Aminosäuren bei der Proteinproduktion immer strikt gemäß der DNA-Sequenz des entsprechenden Gens erfolgt, die zuvor als Bauanleitung in eine Boten-RNA übertragen wird. Unklar ist, warum nicht bereits in den Genen ein vermehrter Einbau von Methionin an kritischen Positionen eines Proteins festgelegt ist. Pan vermutet, dass der "chaotische", also an rein zufälligen Positionen erfolgende Methionineinbau sinnvoll sein könnte. Auf diese Weise entstünden viele unterschiedliche Molekülformen, was die Chance erhöht, dass einige davon die Stresssituation überstehen und so der Zelltod verhindert wird.

 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 