Alzheimer: Wirkstoff gegen krankhafte Proteinstrukturen
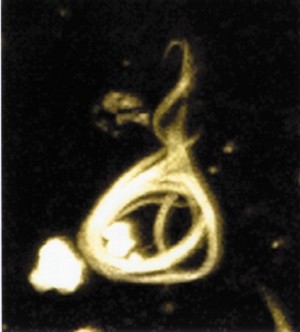
Es könnte sein, dass eine grundlegende biochemische Funktion der gebundenen Zuckermoleküle darin besteht, eine Zusammenlagerung von Proteinen zu verhindern, schreiben David Vocadlo von der Simon Fraser University in Burnaby und seine Kollegen. Es war bekannt, dass das Tau-Protein in den Nervenzellen mit dem Zucker N-Acetylglucosamin (GlcNAc) verbunden wird. Je nach Aktivität eines Enzyms, das diese Verbindung wieder löst, sind die Tau-Proteine dann mit einer größeren oder kleineren Zahl an Zuckermolekülen verknüpft. Warum sich bei Alzheimer-Kranken die Tau-Proteine zu Fibrillenbündeln zusammenlagern und bei Gesunden nicht, ist nicht geklärt.
Die Forscher arbeiteten mit genetisch veränderten Mäusen, die im Lauf des Lebens Ablagerungen aus menschlichen Tau-Proteinen in Hirnzellen bildeten. Sie behandelten junge Tiere mit dem Hemmstoff Thiamet-G, der das zuckerabspaltende Enzym blockiert. Dadurch erhöhte sich innerhalb einer Woche die Menge des an die Tau-Proteine gebundenen Zuckers. Bei behandelten Mäusen, die anfangs noch keine Anzeichen der Krankheit zeigten, bildeten sich im Verlauf von acht Monaten weniger Neurofibrillenbündel und es starben weniger Hirnzellen ab als bei unbehandelten Mäusen. Erkennbare Nebenwirkungen traten dabei nicht auf.
Weitere Untersuchungen zeigten, dass sich auch die Moleküle eines anderen Proteins durch die Verbindung mit GlcNAc-Molekülen weniger leicht zu unlöslichen Aggregaten zusammenlagerten. Die Verbindung zwischen Protein und Zucker erhöht offenbar die Stabilität mancher Proteine in der Zelle. Ein Wirkstoff, der eine übermäßige Abspaltung des Zuckers verhindert, könnte demnach Fibrillenbündel auflösen oder ihre Entstehung blockieren. Das sei, so die Autoren, eine neue Strategie zur Behandlung der Alzheimer-Demenz und anderer Krankheiten, bei denen Tau-Ablagerungen eine Rolle spielen.


 Was Sie schon immer über Mikroben wissen wollten
Was Sie schon immer über Mikroben wissen wollten Energiewende: Schluss mit Schwarz-Weiß-Strategien
Energiewende: Schluss mit Schwarz-Weiß-Strategien Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit
Nicole Bender und Lotte Habermann-Horstmeier: Evolution und Gesundheit 